Um novo estudo consegue, pela primeira vez, integrar o metabolismo ativo em membranas celulares sintéticas abióticas, revelando como a vida pode ter surgido sem ADN, ARN ou proteínas. Em meados do século XX, Stanley Miller realizou um famoso experimento no qual conseguiu gerar compostos orgânicos simples a partir de gases inorgânicos, uma simulação das condições primordiais da Terra. Foi um momento crucial para a ciência, mas deixou uma grande questão sem resposta: comopassamos de matéria inanimada a células funcionais? Décadas depois, essa incógnita continua viva, e uma nova investigação publicada na revista Nature Chemistry acaba de dar um passo crucial para resolvê-la.
Uma equipa da Universidade da Califórnia em San Diego, liderada por Neal Devaraj, conseguiu o que até agora parecia impossível: criar membranas celulares sintéticas capazes de sustentar um metabolismo químico funcional, tudo usando apenas componentes abióticos. O investigador Roberto J. Brea, do Centro de Investigaciones Científicas Avanzadas (CICA) da Universidade de A Coruña, também participou neste avanço, consolidando assim a contribuição espanhola para um dos campos mais promissores da biologia sintética. Esta descoberta não só aprofunda a compreensão das origens da vida na Terra, como também abre novos caminhos no desenvolvimento de tecnologias biomiméticas e aplicações médicas a longo prazo.
A célula antes da célula
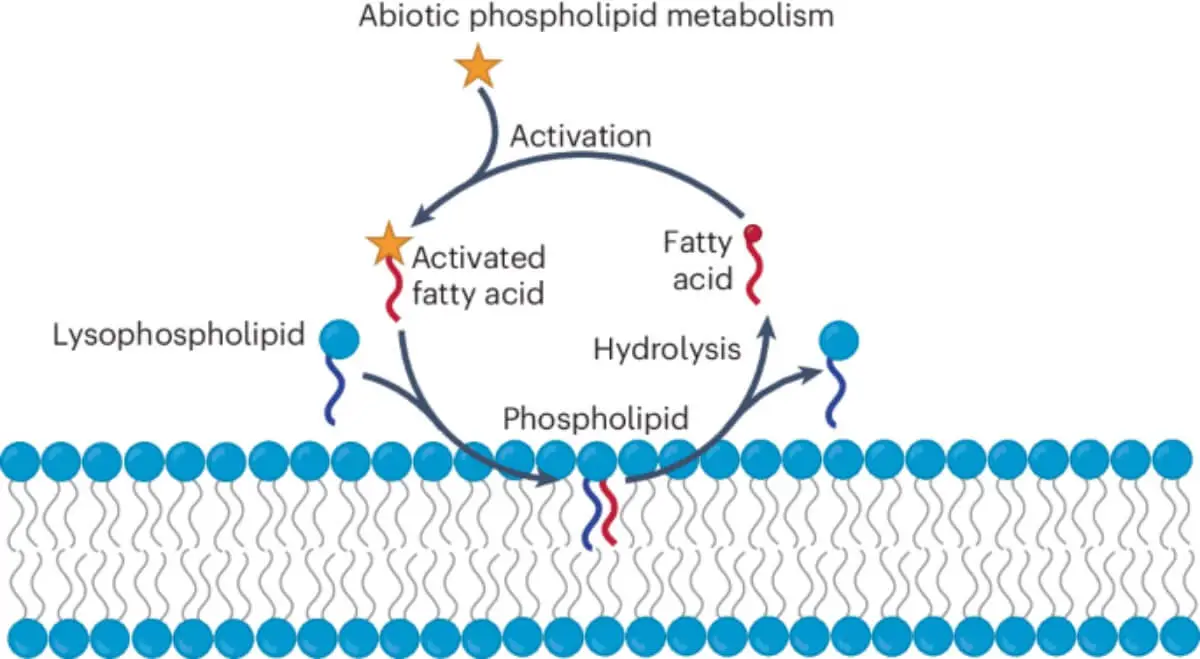
Um dos grandes desafios ao estudar as origens da vida é recriar sistemas que, sem serem biológicos, compartilhem propriedades básicas com os seres vivos. Durante anos, os cientistas conseguiram criar vesículas lipídicas, pequenas esferas que simulam o papel das membranas celulares, ou seja, a compartimentação. No entanto, esse era apenas um dos três ingredientes fundamentais associados à vida: compartimentação, metabolismo e seleção.
Até agora, o metabolismo continuava a ser a peça que faltava. O metabolismo é a rede de reações químicas que permite que uma célula cresça, se repare e responda ao seu ambiente. Criar esta função num ambiente não biológico era um enorme desafio, porque implica ciclos químicos dinâmicos e adaptáveis. A novidade do novo estudo é que os investigadores conseguiram ativar um sistema metabólico funcional dentro de uma membrana abiótica.
Um metabolismo sem vida que funciona
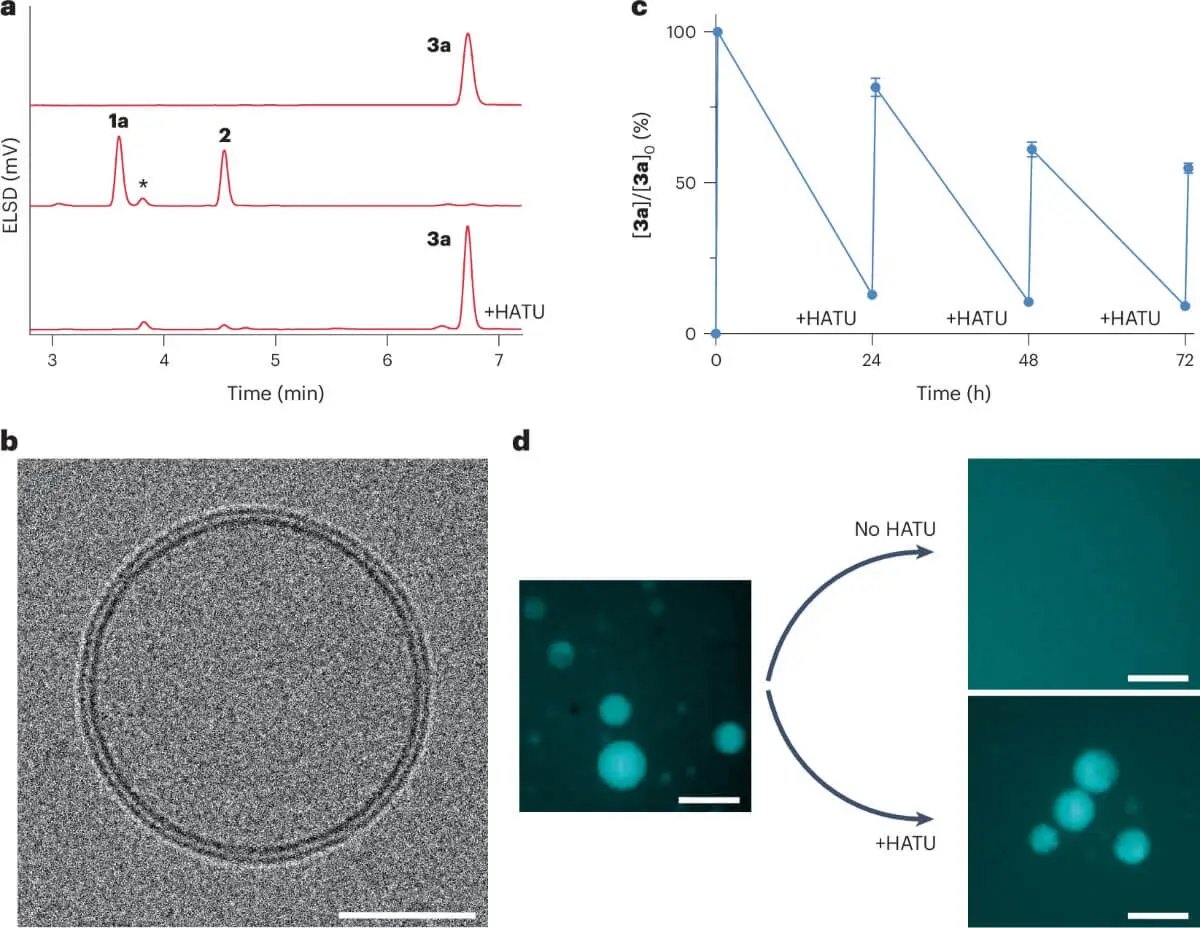
O sistema projetado pela equipa de Devaraj utiliza uma rede química simples, mas eficaz. Através do uso de um combustível químico ativador, os investigadores conseguem que os ácidos gordos se unam aos lisofosfolípidos, formando fosfolípidos. Estes últimos são os componentes básicos das membranas celulares. Sem o combustível, o sistema volta a decompor-se nas suas partes iniciais.
Este ciclo químico não só gera membranas espontaneamente, como também pode repetir-se: formação, degradação e reformação. Nas palavras do artigo original: «Estamos a tentar responder à pergunta fundamental: quais são os sistemas mínimos que têm as propriedades da vida?». E para isso, era indispensável criar uma rede química que não dependesse de enzimas nem de materiais vivos, algo que o grupo conseguiu com sucesso.
Uma membrana que vive… sem estar viva
O que torna esta investigação especial é que as membranas sintéticas não são estruturas estáticas, mas possuem plasticidade, podem adaptar-se, crescer ou mesmo dividir-se sob certas condições. Este comportamento é essencial em qualquer célula viva. Segundo Neal Devaraj, «as células que carecem de uma rede metabólica estão bloqueadas, não são capazes de se remodelar, crescer ou dividir».
Esta experiência ajuda a compreender como uma célula primitiva, antes de conter ADN, ARN ou proteínas, já poderia ter tido um tipo de metabolismo básico. A vida atual, tal como a conhecemos, é complexa, mas a ideia é reconstruir essa complexidade a partir de camadas mais simples e funcionais. Alessandro Fracassi, primeiro autor do estudo, explica com clareza: «Estamos a tentar recriar uma célula primitiva, mas funcional, uma camada de cada vez».
Ciência básica com impacto real
Embora este trabalho se concentre numa questão fundamental — a origem da vida —, suas implicações vão além do campo teórico. Compreender como projetar células artificiais com funções mínimas pode abrir portas em campos como a biofabricação, a medicina ou a remediação ambiental. Por exemplo, cápsulas sintéticas capazes de liberar medicamentos de forma controlada ou sensores que imitam o comportamento de células vivas.
Além disso, esses sistemas têm a vantagem de não depender de materiais biológicos reais, o que permite um controlo mais preciso e evita certos riscos associados à manipulação genética. Se, no futuro, for possível adicionar funções mais complexas, como replicação ou evolução direcionada, estaríamos diante de modelos experimentais para observar fenómenos biológicos de forma isolada e controlada.CiênciaA Terra era um «oceano verde» há milhares de milhões de anos: a experiência que revela isso e muda o que sabemos sobre a origem da vidaEugenio M. Fernández Aguilar
Os próximos passos da investigação
A equipa de Devaraj não pretende parar por aqui. O seu objetivo é continuar a adicionar complexidade camada por camada, até construir um modelo de célula que incorpore mais características próprias da vida. Para isso, será necessário integrar funções como o armazenamento de informação, a síntese de proteínas simples ou respostas mais elaboradas ao ambiente.
Mesmo assim, os investigadores estão cientes de que este caminho é longo. Como reconheceu o próprio Devaraj: «É possível que não vejamos este tipo de avanços durante 10 ou 20 anos. Mas temos de fazer o trabalho hoje, porque ainda temos muito a aprender». A paciência é uma parte essencial da ciência, especialmente quando se trata de reconstruir do zero os primeiros passos que deram origem à vida tal como a conhecemos.
